2C-G
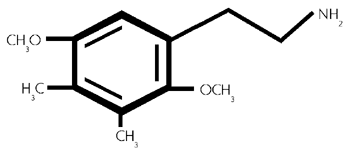
Formel aus:
(42/522)
Andere Namen:
2,5-Dimethoxy -3,4- dimethylphenethylamin. (42/522)
Dosis:
A. Shulgin gibt eine Dosis von 20-35 mg an. (42/525)
Wirkdauer:
A. Shulgin gibt eine Wirkdauer von 18-30h an. (42/525)
Sucht:
Die Ausbildung einer koerperlichen Abhaengigkeit ist nicht bekannt. (eigen)
Synthese:
Von A. Shulgin wird in seinem Buch "PHIKAL" folgendes Verfahren zur Herstellung angegeben:
Zu einer klaren Loesung von 40.4g KOH Plaetzchen in 400 ml warmen EtOH wurden 86.5g 2,3-Xylenol hinzugefuegt, gefolgt von 51.4g Methyliodid. Diese Mischung wurde fuer 2 Tage am Rueckflusskochen gehalten. Die fluechtigen Stoffe wurden im Vakuum entfernt. Der Rest wurde in 1l H2O geloest, und mit 4x200 ml CH2Cl2 extrahiert. Die gesammelten Extrakte wurden mit 5%-iger NaOH gewaschen, bis die Waschungen basisch blieben. Es folgte eine einzige Waschung mit verduennter HCl. Dann wurde das Loesungsmittel im Vakuum entfernt. Der Rest, 41.5g stechend riechendes, bernsteinfarbenes Oel, kristallisierte ploetzlich. Der mp von 2,3-Dimethylanisol war 25-26 Grad Celsius. Es wurde ohne weitere Reinigungen im naechsten Schritt verwendet. Von den waessrigen, basischen Waschungen, gefolgt von Ansaeuerung, Extraktion, und dem Entfernen des Loesungsmittels, wurden 46.5g rohes unverbrauchtes Xylenol erhalten, welches wiederverwertet werden koennte.
Eine Mischung von 205g POCl3 und 228g N-Methylformanilid wurde es erlaubt sich zu entwickeln bei Zimmertemperatur, bis zur Entwicklung einer dunklen, weinroten Farbe mit einiger ploetzlicher Erwaermung. Zu dem wurden 70.8g 2,3-Dimethylanisol hinzugefuegt. Die dunkle Reaktionsmischung wurde fuer 2.5h auf dem Dampfbad erhitzt. Das Produkt wurde dann in 1.7l H2O gegossen und geruehrt, bis es eine ploetzliche Kristallisation gab. Diese Feststoffe wurden durch Filtration entfernt, mit H2O gewaschen und luftgetrocknet, um 77.7g eines rohen Benzaldehyds, als braune Kristalle, zu ergeben. Dies wurde bei 70-90 Grad Celsius mit einem Druck von 0.4mm/Hg destilliert, um 64.8g 2,3-Dimethyl-4-methoxybenzaldehyd, als weisses kristallines Produkt mit einem mp von 51-52 Grad Celsius, zu ergeben. Umkristallisieren aus MeOH ergab ein analytisches Beispiel mit einem mp von 55-55.5 Grad Celsius. Das Malononitrilderivat (aus dem Aldehyd und Malononitril in EtOH mit einem Tropfen Triethylamin) hatte einen mp von 133-133.5 Grad Celsius aus EtOH. Vor kurzen wurde dieses Aldehyd kommerziell erhaeltlich.
Eine Loesung von 32.4g 2,3-Dimethyl-4-methoxybenzaldehyd in 800 ml CH2Cl2 wurde mit 58.6g 85%-iger m-Chlorperoxybenzoesaeure versetzt und wurde fuer 3 Tage am Rueckfluss gehalten. Nach dem Abkuehlen auf Zimmertemperatur wurden die weissen Feststoffe (m-Chlorbenzoesaeure) durch Filtration entfernt (rund 40g wenn trocken). Das Filtrat wurde mit einigen Portionen von gesaettiger NaHCO3-Loesung extrahiert (Bei der Ansaeuerung ergab diese waessrige Waschung zusaetzliche m-Chlorbenzoesaeure) und die organischen Loesungsmittel wurden im Vakuum entfernt. Der kristalline Rest (32g schwer und tief gefaerbt) wurde in 150 ml kochendem MeOH geloest, zu welchem 18g festes NaOH hinzugefuegt wurden, dann wurde die Loesung auf dem Dampfbad fuer einige Min. erhitzt. Die Mischung wurde zu 800 ml H2O hinzugefuegt. Eine kleine Schaumoberflaeche wurde mechanisch mit einem Stueck Filterpapier entfernt. Die Loesung wurde mit konz. HCl angesaeuert, worauf sich 30.9g von einem gelbbraunen Feststoff ablagerten. Umkristallisieren aus H2O ergab 2,3-Dimethyl-4-methoxyphenol als weisse Nadeln, mit einem mp von 95-96 Grad Celsius. Das N-Methylcarbamat wurde durch die Behandlung von einer Loesung Phenol (1g in 75ml Hexan mit 5ml zugefuegtem CH2Cl2) mit 2g Methylisocyanat und wenigen Tropfen Triethylamin erzeugt. Der blass pinkfarbene Feststoff, der sich abtrennte, wurde aus MeOH umkristallisiert, um ein Produkt zu ergeben, dass einen mp von 141-142 Grad Celsius hatte.
Zu einer Loesung von 23.1g KOH Plaetzchen in 250 ml heissem EtOH wurden 61.8g 2,3-Dimethyl-4-methoxyphenol hinzugefuegt, gefolgt von 60g Methyliodid. Dies wurde 12h lang am Rueckfluss gehalten, dann von Loesungsmittel im Vakuum befreit. Der Rest wurde in 1.2l H2O geloest, mit HCl angesaeuert, und mit 3x200 ml CH2Cl2 extrahiert. Die vereinten Extrakte wurden mit 3x100 ml 5%-iger NaOH gewaschen. Das Loesungsmittel wurde im Vakuum entfernt. Der Rest bildete eine gebrochen-weisse Masse von Blaettchen, die 37.7g, nach Filtration und Lufttrocknen, wogen. Umkristallisieren aus MeOH gab 2,3-Dimethyl-1,4-dimethoxybenzol als weissen Feststoff, mit einem mp von 78-79 Grad Celsius.
Eine alternative Route, die von 2,3-Xylenol zu diesem Diether via Stickstoff-beinhaltende Zwischenstoffe fuehrt, wurde erforscht. Die Reihe umfasste die Reaktion von 2,3-Xylenol mit salpetriger Saeure (4-Nitrosoprodukt, mp 184 Grad Celsius dec.), die Reduktion mit Natriumdithionit (4-Aminoprodukt, mp rund 175 Grad Celsius), die Oxydation mit Salpetersaeure (Benzoquinon, mp 58 Grad Celsius), die Reduktion mit Natriumdithionit (Hydroquinon) und anschliessender Methylation mit Methyliodid. Die Ausbeute war geringer mit dieser Methode.
Einer Mischung von 88g POCl3 und 99g N-Methylformanilid wurde es erlaubt sich zu entwickeln, bis sich eine tiefe, weinrote Farbe gebildet hatte. Dann wurde alles mit 36.5g 2,3-Dimethyl-1,4-dimethoxybenzol versetzt und auf dem Dampfbad fuer 3h erhitzt. Es wurde dann in 1l H2O gegossen, und geruehrt bis die Bildung von einer lockeren, kruemmeligen, dunklen und kristallinen Masse fertig war. Diese wurde durch Filtration entfernt, und in 300 ml CH2Cl2 geloest. Nach dem Waschen zuerst mit H2O, dann mit 5%-iger NaOH, und schliesslich mit verd. HCl, wurde das Loesungsmittel im Vakuum entfernt, was eine Ausbeute von 39.5g eines schwarzen Oels, dass sich verfestigte, ergab. Dieses wurde mit 2x300 ml kochendem Hexan extrahiert. Die Extrakte wurden vereinigt, und das Loesungsmittel im Vakuum entfernt. Der gelbliche Rest kristallisierte, um 32.7g 2,5-Dimethoxy-3,4-dimethylbenzaldehyd mit einem mp von 46-47 Grad Celsius zu ergeben. Wiederholtes Umkristallisieren aus MeOH hob den mp auf 59-60 Grad Celsius. Das Malononitrilderivat wurde bereitet (Aldehyd und Malononitril in EtOH mit wenigen Tropfen Triethylamin), als gelbe Kristalle aus EtOH, mit einem mp von 190-191 Grad Celsius.
Zu einer Loesung von 16.3g 2,5-Dimethoxy-3,4-dimethylbenzaldehyd in 50 ml Nitromethan wurden 3g wasserfreies Ammoniumacetat hinzugefuegt. Die Mischung wurde auf dem Dampfbad ueber nacht erhitzt. Es wurde dann das gleiche Volumen MeOH hinzugefuegt. Mit Kuehlen wurden eine feine Ernte von gelben Kristallen erhalten. Diese wurden durch Filtration entfernt, mit MeOH gewaschen, und luftgetrocknet, um 4.4g 2,5-Dimethoxy-3,4-dimethyl-beta-nitrostyren mit einem mp von 120-121 Grad Celsius, welcher nicht durch Umkristallisieren aus MeOH (50 ml/g) verbessert wurde, zu erhalten. Die Mutterloesungen der obigen Filtration wurden mit H2O verduennt, bis zum Punkt der dauernden Truebung, dann in eine kalte Box weggeraeumt. Es entwickelte sich ein klobiger, gekoernter, tomatenroter Kristall, der 2.5g wog, als er trocken war. Es hatte einen mp von 118-119.5 Grad Celsius, der nicht erniedrigt war in einem gemischten mp mit dem gelben Beispiel. Beide Formen hatten identische NMR Spektren.
Eine Loesung von LAH (56ml von einer 1M Loesung in THF) wurde mit einem externen Eisbad, unter He, bis auf 0 Grad Celsius abgekuehlt. Mit kraeftigem Ruehren wurden 1.52 ml 100%-iger H2SO4 tropfenweise zugefuegt, um das Verkohlen zu minimieren. Dies wurde gefolgt von der Zugabe von 3.63g 2,5-Dimethoxy-3,4-dimethyl-ß-nitrostyren in 36ml wasserfreiem THF ueber die Dauer von 1h. Nach wenigen Min. weiterem Ruehren, wurde die Temperatur auf einen sanfte Rueckflusskochtemperatur auf dem Dampfbad fuer rund 5 Min. gebracht. Dann wurde alles wieder abgekuehlt auf 0 Grad Celsius. Das ueberschuessige Hydrid wurde durch die vorsichtige Hinzufuegung von 9ml IPA zerstoert, gefolgt von 2.5ml 15%-iger NaOH und schliesslich 7.5ml H2O. Die Reaktionsmischung wurde filtriert. Der Filterkuchen wurde zuerst mit THF und dann mit IPA gewaschen. Das Filtrat wurde vom Loesungsmittel im Vakuum befreit. Der Rest wurde bei 110-120 Grad Celsius mit einem Druck von 0.2 mm/Hg destilliert, um 2.07g 2,5-Dimethoxy-3,4-dimethylphenethylamin, als ein klar weisses Oel, zu ergeben. Dies wurde in 10 ml IPA geloest, mit konz. HCl neutralisiert, und dann mit 25ml wasserfreiem Et2O verduennt. Die Kristalle, die sich bildeten, wurden abfiltriert, Et2O gewaschen, und bis zu einem konstantem Gewicht luftgetrocknet. Es wurden 2.13g schoener weisser Kristalle aus 2C-G-HCl, mit einem mp von 232-233 Grad Celsius, erhalten. Anal. (C12H20ClNO2) C,H. (42/522ff.)
Wirkungen:
Von dieser wenig bekannten, halluzinogenen Rauschdroge existieren nur die Wirkungsbeschreibungen aus A. Shulgins Buch "PHIKAL", die wie folgt lauten:
32 mg: Praechtiges Material. Es kann als 'wahres Halluzinogen' klassifiziert werden, ausser jemand publiziert, in welchen Fall es am besten als 'Einsichtsverstaerker' beschrieben werden koennte. Es gab keine besonderen visuellen Auswirkungen, wenigsten fuer mich. Der asexuelle und appetitlose Aspekt moegen mit steigender Vertrautheit schwinden. Die Laenge der Erfahrung spricht gegen den haeufigen Gebrauch, was eine Schande ist, denn diese Substanz ist es sehr wohl wert, sooft wiemoeglich untersucht zu werden. (42/525)
32 mg: Am Plateau nach 2h angelangt, mit gerade ein bisschen Magenuebelkeit. Und ich bin einige Stunden spaeter immer noch am Plateau. Ich schlafe schlussendlich in der 18. h, aber auch nach dem Aufstehen und dem Erledigen aller moeglichen Dinge am naechsten Tag, war ich nicht komplett herunten bis am Abend. Und ein paar Tage mehr fuer das, was eine komplette Reparatur genannt wird. Das ist ein langer Weg fuer diese kleine Menge an Droge. (42/525)
Allgemeines:
Dieses Halluzinogen ist ein Phenethylamin. Diese Verbindung ist damit mit einer Reihe anderer Halluzinogene aus dieser Gruppe nahe chemisch verwandt, beispielsweise mit dem natuerlichen Halluzinogen Meskalin, dem Hauptalkaloid des Peyote (Lophophora-Kaktus). Die einzelnen, psychoaktiven Phenethylamine unterscheiden sich nur durch die Art der Substituenten am aromatischen Benzolring. (eigen)
Haengt man bei einem Phenethylamin noch eine Methylgruppe an der Ethylaminseitengruppe an, kommt man zu der Gruppe der Amphetamine. Grundsaetzlich scheint die Regel zu gelten, dass wenn ein Phenethylamin psychoaktiv ist, ist auch sein Amphetamingegenstueck wirksam ist. Mehr noch, es ist sogar allgemein etwas staerker. (eigen)
Hier ist das erste Beispiel, von einem Phenethylamin, dass von fast der gleichen Staerke wie das verwandte 3-Kohlenstoff Amphetamin GANESHA ist. Bei der ersten Annaeherung ist man kaum in der Lage, von den aufgezeichneten Daten irgendeinen groesseren Unterschied entweder in Dosis, in der Dauer, oder in der Natur der Wirkung, zwischen 2C-G und GANESHA selbst, zu unterscheiden. (42/525f.)