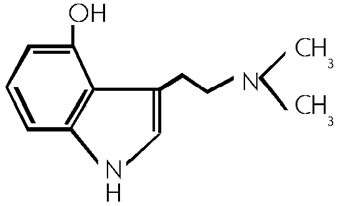
Psilocin
Formel aus:
(3, 17, 62, 101/468)
Andere Namen:
4-Hydroxy-DMT, (23, 101/468) 3- [2- (dimethylamino) ethyl]- 1H- indol -4- ol, 4-Hydroxy -N,N- dimethyltryptamin, (62) Tryptamine, 4-hydroxy-N,N-dimethyl; 4-Indolol, 3-[2-(Dimethylamino)ethyl]; N,N-Dimethyl-4-hydroxytryptamin; 3-[2-Dimethylamino)ethyl]-4-indolol; CX-59; PSOH (engl.). (101/468)
Dosis:
Der angegebene Dosisbereich schwankt von einer Startdosis von 5 mg oral (23) oder 6 mg (62) bis zur vollen Dosis von 10 mg Psilocin. (14) Shulgin spricht von einem Dosisbereich von 10-20 mg, egal ob die Substanz als Indolol, Acetat oder Phosphat vorliegt. (101/469)
Wirkdauer:
A. Hofmann gibt die Dauer der halluzinogenen Wirkung mit 4-6h an,(14) A. Shulgin spricht eher von 3-6 Stunden. (101/469)
Spezifikation:
C12H16N2O; Molekulargewicht 204,27; Blaettchen aus MeOH, mp 173-176 Grad Celsius, leicht loesl. in H2O, loesl. in MeOH, EtOH, CHCl3. (62)
Vorkommen:
Copelandia cyanescens;
Gymnopilus pupuratus;
Inocybe aeruginascens;
Panaeolus cyanescens, P. sphinctrinus, P. subbalteatus;
Pluteus salicinus;
Psilocybe baeocystis, P. caerulescens, P. cubensis, P. cyanescens, P. mexicana, P. pelliculosa, P. semilanceata, P. stuntzii;
Allgemeines:
Psilocin kommt in fast allen halluzinogenen Pilzen der Familien Psilocybe (Kahlkoepfe), Panaeolus (Duengerlinge) und Copelandia (Samthaeubchen) vor. Die Gesamtwirkung der halluzinogenen Pilze dieser Familien setzt sich aus den unterschiedlichen, in den Pilzen enthaltenen Mengen an Psilocin, Psilocybin und Baeocystin zusammen. Die Rauschdroge ist sehr nahe mit Psilocybin und DMT verwandt, denn es hat die gleiche Grundstruktur wie diese, eben die Struktur eines Tryptamins. Entfernt man die Hydroxygruppe von Psilocin erhaelt man DMT. Wird hingegen die Hydroxygruppe durch eine Phosphoryloxygruppe ersetzt erhaelt man das Halluzinogen Psilocybin, allesamt Tryptamine. Diese Drogen gehoeren somit von der chemischen Struktur zu den Tryptaminen. Diese Verbindungsklasse enthaelt nicht nur halluzinogene Rauschdrogen, sondern auch andere wichtige Substanzen, beispielsweise das Serotonin, welches im Gehirn des Menschen eine wesentliche Rolle spielt. Dort ist es ein essentieller Neurotransmitter, der bei der Weiterleitung von Aktionen/Steuerinformationen mitbeteiligt ist, sozusagen ein Teil des Leitungssystems. (eigen) Die Verbindung Psilocin ist unbestaendig, (39, 40) da sie leicht oxydiert wird. (47) Deswegen wurde auch das Halluzinogen Psilocybin von der Fa. Sandoz angeboten und nicht Psilocin, welches luftdicht und in braunen lichtgeschuetzten Flaschen aufbewahrt werden muesste. (eigen) Die vom Menschen aufgenommene Gesamtmenge wird uebrigens beinahe unveraendert im Harn ausgeschieden. (62)
Wirkungen:
Es aehnelt LSD in der Wirkung (39) und wirkt gleich wie Psilocybin. (13, 62) Die Verbindung ist aber 1,4x so potent wie Psilocybin. (62) Psilocin ist von der Wirkung ein typisches Halluzinogen, und es ist mit den gleichen Gefahren, wie beim Konsum von Psilocybin zu rechnen. (eigen)
Nachweis:
Metoltest (51/73)
Sucht:
Die Ausbildung einer koerperlichen Abhaengigkeit ist nicht bekannt. (eigen)
Gegengift:
Psilocin ist chemisch und von der Wirkung sehr nahe mit Psilocybin verwandt und deshalb kann man annehmen, dass die gleichen Methoden bei Notfaellen angesagt sind:
Mittel der ersten Wahl bei einer problematischen Psilocinerfahrung ist die positive Veraenderung der Umgebung. Ruhe, frische Luft und beruhigende Worte, die Methodik des "talk-downs", helfen einem Grossteil der Konsumenten ueber ihre schlechte Phase hinweg. Meistens sind es Aengste und verdraengte Inhalte frueherer Zeiten, die den Konsumenten bedraengen. Er kann sich aber auch durch die Umgebung, durch die starke Steigerung der Emotionalitaet die eben dem Halluzinogenrausch anhaftet, bedroht fuehlen. Das Auftreten negativer Eigen- und Fremdstimmungen und die Einnahme von Halluzinogenen an ungeeigneten Orten ist die Hauptursache von Problemen. T. Learys Theorie vom set und setting hat sich bestaetigt. Nur die Einnahme bei guter Grundstimmung und in der passenden Umgebung fuehrt zu einem positiven Erlebnis durch die Einnahme. Sollten aufarbeitungsnotwendige Erlebensinhalte reproduziert werden, ist es der erfahrene Begleiter, der diese therapeutisch aufarbeiten muss. Die erstmalige Einnahme von Halluzinogenen setzt erfahrene Begleitung voraus, um Schaeden zu verhindern. Eine Einnahme alleine ist nur fuer erfahrene Konsumenten problemlos.
Sollten die Umstaende lebensbedrohlich fuer den User oder die Umgebung werden, ist erst der Einsatz von Medikamenten gerechtfertigt. Es werden Anxiolytika, (z. Bsp. Tranxilium, Valium, Rohypnol) aus der Gruppe der Benzodiazepine, oder auch klassische Neuroleptika verwendet werden. Gegen die Verwendung von alten Neuroleptika sprechen die starken Nebenwirkungen und bleibende Schaeden. Neuroleptika sind erst angezeigt, wenn verlaengerte Rauschzustaende auftreten, und man annehmen muss, dass durch die Einnahme des Halluzinogens eine Psychose ausgeloest wurde. Die Verwendung des neuen d2/5-HT2-Antagonisten Risperidon kann erwogen werden, doch diese Verbindung ist noch nicht genuegend untersucht worden. (eigen)
Synthese:
Zu einer Loesung von 0,5g 4-Acetoxyindol (die Bereitung ist im Rezept fuer 4-Hydroxy-DET beschrieben) in 4ml Et2O, die geruehrt und mit einem aeusserlichen Eisbad gekuehlt wurde, wurde tropfenweise, eine Loesung von 0,5ml Oxalylchlorid in 3ml wasserfreiem Et2O hinzugefuegt. Das Ruehren wurde fuer 0,5h fortgesetzt und das Zwischenprodukt Indolglyoxylchlorid wurde als gelber, kristalliner Feststoff abgetrennt, aber nicht rein isoliert. Es wurde dann tropfenweise eine 40%-ige Loesung von Dimethylamin in Et2O hinzugefuegt, bis der pH ungefaehr 8-9 erreichte. Die Reaktion wurde dann durch die Zugabe von 100 ml CHCl3 abgebrochen. Die organische Phase wurde zuerst mit 30 ml 5%-iger NaHSO4-Loesung, dann mit 30 ml gesaettigter NaHCO3 und abschliessend mit 30 ml gesaettigtem brine (******) gewaschen. Nach dem Trocknen mit wasserfreiem MgSO4 wurde das Loesungsmittel im Vakuum entfernt. Der Rest bildete Kristalle, die nach dem Umkristallisieren aus THF, ganze 0,61g (80%) 4-Acetoxyindol-3-yl-N,N-dimethylglyoxylamid mit einem mp von 204-205 Grad Celsius ergaben.
Eine Suspension von 0,38g LAH in 10 ml wasserfreiem THF wurde in einer Inertathmosphaere gehalten und kraeftig geruehrt. Zu dieser wurden dann tropfenweise eine Loesung von 0,55g 4-Acetoxyindol-3-yl-N,N-dimethylgyoxylamid in 10 ml wasserfreiem THF mit einer Rate gegeben, die ein sanftes Kochen am Rueckfluss ermoeglichte. Nachdem die Addition abgeschlossen war, wurde das Kochen am Rueckfluss fuer zusaetzliche 15 Min. durchgefuehrt. Die Reaktionsmischung wurde anschliessend auf 40 Grad Celsius abgekuehlt, und das ueberschuessige Hydrid zerstoert durch die Zugabe von Wasser, welches mit wenig THF verduennt war. Die Reaktionsmischung wurde unter einer N2 Athmosphaere frei von unloeslichen Materialien filtriert. Die resultierenden Feststoffe wurden mit THF gewaschen. Das Filtrat und die Waschungen wurden kombiniert und vom Loesungsmittel unter Vakuum befreit. Der Rest wurde in einem Kugelrohrapparat destilliert. Das feste Destillat wurde aus EtOAc/Hexan umkristallisiert, um 3-[2-(Dimethylamino)ethyl]-4-indolol (4-OH-DMT, Psilocin) als ein weisses Oel, welches sich verfestigte, zu ergeben. Umkristalliseren aus EtOAc(Hexan ergab weisse Kristalle mit einem mp von 103-104 Grad Celsius. Das abschliessende Gewicht waren 0,23g. Die Ausbeute betrug damit 56%. IR (in cm-1): 686, 725, 832, 991, 1040 and 1055; Die OH-Dehnung ist bei 3240. MS (in m/z): C3H8N+ 58 (100%); Elternionen 204 (15%); Indolmethylen+ 146 (3%); 159 (2%). (101/468)
Geschichte:
1959: Isolation aus Psilocybe mexicana und Strukturaufklaerung durch Hofmann A. et al. (17, 62)
1959: Synthese von Psilocin durch Hofmann A. (62)
1960: Blaschko, Levine und Bocks sowie Horita und Weber untersuchten die biochemischen Reaktionen von Psilocybin und Psilocin in vitro. Sie stellten fest, dass nur Psilocin fuer die typische blaugruene Faerbung verantwortlich ist. Die Phosphatgruppe, die an der 4. Position des Tryptamingeruestes bei Psilocybin verankert ist, verhindert die Oxydation zu den Chinonen, die vermutlich die typischen Farbstoffe bilden. (51/73)
1962: Isolation aus Psilocybe baeocystis durch Leung J. (62)